第541号 「ヘルスケア分野で利用が進むGS1標準」~医療機器のバーコード表示規制とトレーサビリティ強化の動向~ (2024年10月10日発行)
| 執筆者 | 植村 康一 一般財団法人流通システム開発センター(GS1 Japan) ソリューション第2部 部長 |
|---|
執筆者略歴 ▼
目次
- はじめに
- 1.UDI(Unique Device Identification)
- 2.UDI規制と世界動向
- 3.今後の医療機器トレーサビリティとUDI
はじめに
トレーサビリティという言葉が一般に使われるようになったのは、BSE(牛海綿状脳症)問題以降であろう。英国を中心に感染が広がったBSEは本邦でも確認されるようになり、2003年6月には、「牛の個体識別のための情報の管理及び伝達に関する特別措置法」、いわゆる牛肉トレーサビリティ法が成立した。これにより2004年12月以降に食肉処理された国産牛肉には、流通や小売り段階において個体識別番号が表示されるようになっている。
BSE問題は医療機器のトレーサビリティにも大きな影響を与えた。BSE感染牛の摂取により発症するとされたクロイツフェルト・ヤコブ病(CJD)において、患者に用いた手術器具の洗浄・滅菌が二次感染を防ぐうえで課題とされたためである。CJDの防止ガイドラインが多くの国で公表されているが、その中には感染防止に対する手術器具のトレーサビリティの重要性が述べられている*1~2。
欧州では、2011年にシリコン豊胸材の破裂被害が起こっているが、この事故が医療機器のトレーサビリティの必要性をさらに強く突き付けることとなった 。当該材料が使用された患者は、フランスだけでも3万人以上にのぼり、販売された65か国以上での合計患者数は数十万人に及ぶといわれている。危険性を排除するためには体内から取り出す手術も必要であるが、いまだにすべての患者が特定できておらず回収は完了していない。
このような経緯により、特に欧州を中心に医療機器のトレーサビリティは非常に重要な課題としてとらえられるようになってきた。本稿では、世界的に進む医療機器のトレーサビリティへの取り組みを、UDI(Unique Device Identification:医療機器固有識別)の考え方から解説する。
1.UDI(Unique Device Identification)
UDIという言葉と理念は、米国FDA(Food and Drug Administration:食品医薬局)が医療機器へのバーコード表示とデータベース登録の義務化を求めた「UDI規則」を2013年に公布したこと、さらに同年、日本を含む各国の規制当局で構成されるIMDRF(International Medical Devices Regulators forum:国際医療機器規制当局フォーラム)が「UDIガイダンス」を公表したことにより急速に世界各国に広まった4,5)。
UDIの根幹は下記の2つである。これらをサプライヤーや医療機関が共通で使用することにより、迅速なリコール回収や医療事故の防止が図れるとされている。
1)製品と包装を特定するための識別コードの設定とデータキャリア(バーコードなど)の表示
2)識別コードを含む機器の固定情報のデータベース登録とその利用
IMDRFは、識別コードとデータキャリアには国際標準を利用することと、データベースには規制当局が積極的にかかわり、地域の関係者が使いやすいものを構築するということを提唱している。このうち識別コードとデータキャリアにはGS1(ジーエスワン)標準 が最も一般的に利用されている。
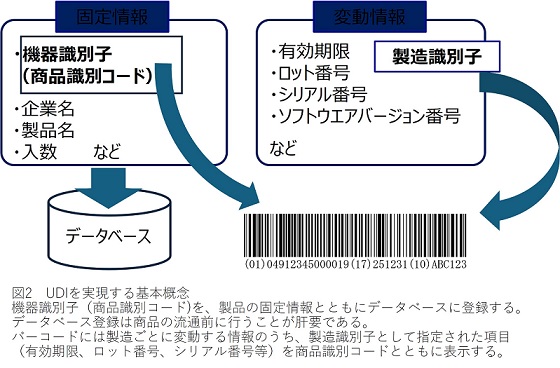
図1は、商品識別コード、有効期限、ロット番号が表示された最も一般的なバーコード表示例である。UDIのバーコードには商品識別コード以外にロット番号や有効期限といった製造ごとに変動する値を表示する。この商品識別コードとロット、有効期限といった組み合わせで製品の特定が可能となる。心臓ペースメーカや輸液ポンプなど一つ一つの製品を区別する必要があるものにはシリアル番号が使用される。
一方、データベースには、商品名や製造者といった情報に加えて、商品識別コードを主キーとして登録する。これにより誰もがこの商品識別コードを用いて商品情報を得ることが可能となる(図2)。IMDRFのUDIガイダンスにはデータベースについての基本的な考え方やコアデータ項目なども提案されている。
2.UDI規制と世界動向
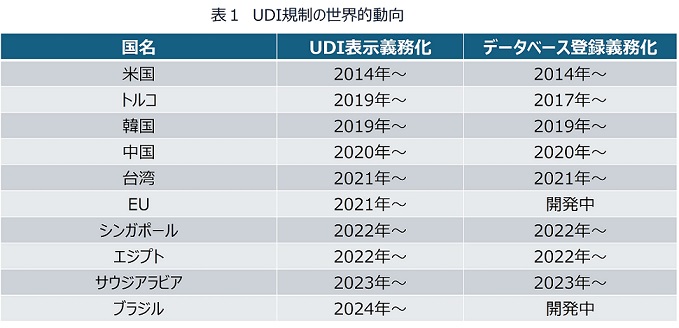
医療機器のトレーサビリティを考える上で、今やUDIを避けては通れない。IMDRFが2013年にUDIガイダンスを出したのち、医療機器の安全性を確保しようという動きは世界中に広がり、多くの国がUDIの考え方を取り入れて、医療機器のバーコード表示とデータベース登録を進めてきた(表1)。包装単位はもちろん、医療機関で繰り返し利用されるもの(輸液ポンプや人工呼吸器など)には医療機器本体にもバーコードの表示を行い、さらに手術用鋼製器具など滅菌洗浄が繰り返し施されるものには、レーザー刻印などを用いて製品本体にダイレクトマーキングを行うということが世界の常識となりつつある(図3)。
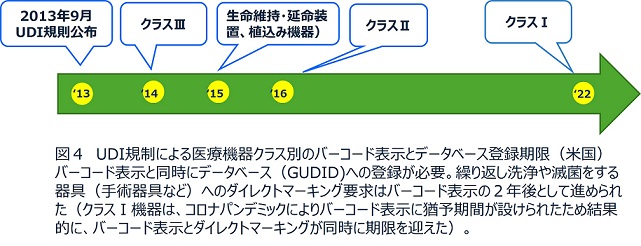
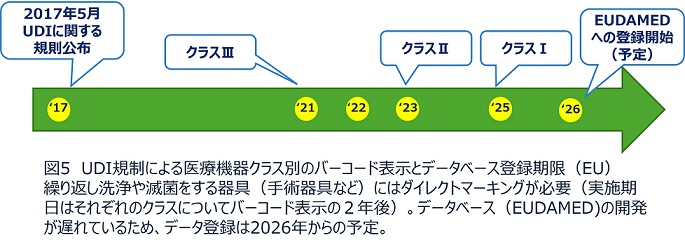
図4、5は米国およびEUでのUDI規制のスケジュールである。医療機器はリスクの高いものからクラスⅢ、Ⅱ、Ⅰと分類されるが、すでに米国ではすべての医療機器について、バーコード表示とデータベース登録を行わなければ市場で流通させることができない状況にある。EUでもクラスⅢとⅡ機器へのバーコード表示は期限をすでに迎えており、今後クラスⅠにも表示義務が拡大する。データベース(EUDAMED)の開発が当初のスケジュールよりかなり遅れているが、2026年からは登録が義務化される予定である。EUのUDI規制はまだ始まったばかりであるが、ペースメーカや人工関節など体内に埋め込んで使う製品(インプラント製品)に関しては医療機関側にもUDI情報を電子的に記録するという義務をかけている。このような管理により、万が一回収が必要となった際にもより迅速な対応を取ることが可能となっている。
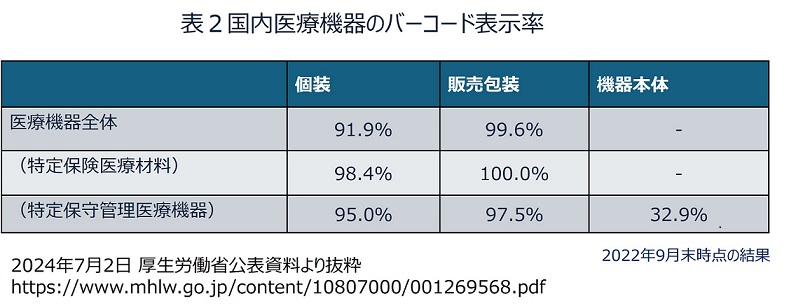
この世界的な流れにやや乗り遅れているのが日本である。2019年に改正された薬機法(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律)により、バーコード表示が義務となったものの、その対象は販売包装単位のみである。本体表示やダイレクトマーキングは対象外であり、データベース登録も推奨に過ぎない。そのため医療現場での利用に制限が出ているという実態がある。日本では欧米より早い1999年から医療機器業界主導でトレーサビリティを意識したバーコード表示が進められてはいた。これにより包装へのバーコード表示は進み、特に保険償還が可能な特定医療保険材料ではほとんどすべての製品にバーコードが表示されるようになっている。しかし医療機器本体へのバーコード表示やデータベース登録など不十分な部分が多く、本体表示が特に有効と思われる特定保守管理医療機器でも機器本体にバーコードが表示されているものはわずか30%程度である(表2)。残念ながら、今やUDIに関しては後進国と言わざるを得ない。
3.今後の医療機器トレーサビリティとUDI
医療機器の範囲は非常に広い。病院で利用されるCTやMRIなどの大型機器、人工呼吸器や輸液ポンプなどの可搬機器から、注射のシリンジやメス、鉗子、体温計や絆創膏まで様々なものが存在する。また、医療機器は輸出入が盛んで、製品包装を変えずに流通されることが多い。そのため国際的な調和を図り、商品識別コードやデータキャリアには国際的に標準化されたものを用いることで、国ごとのコード変換やバーコードの再貼付を行わないようにしようとするのがUDIの考え方である。このことにより国をまたいだ形でのトレーサビリティも可能となると考えられている。さらに、医療機器の特性として、患者に使用された医療機器、あるいは体内に埋め込まれた医療機器(心臓ペースメーカやステントなど)が何であるのか、患者側ではわからない可能性があるということがある。この点が見た目で判断できる家電製品や自動車などとの違いかもしれない。
国内でも、心臓ペースメーカを利用している患者には詳細情報が書かれた手帳が配布され、また心臓ペースメーカを含む特定医療機器と呼ばれるものについては、「特定医療機器トラッキング制度」が設けられている。この制度は製造者側に利用者の連絡先などの情報の記録と保存を義務付けるものであるが、あくまで希望する患者の自主登録によって成り立っている制度であり、紙媒体をベースに考えられた制度であることはいなめない。必要な製品情報が、使用された患者まで電子的につながる状態にできるのかが、医療機器のトレーサビリティを考える上では重要である。マイナポータルを通して処方された医薬品については患者も確認できるような時代になりつつあるが、この仕組みがさらに拡大し、医薬品はもとより、体内に埋め込まれた医療機器の情報も、必要な場合にはすべての医療機関で確認できるようになれば良いと考えるが、そのような時代が来るのであろうか。
今後日本がどのような形でUDIを進めていくのかはまだ決定していない。すでに海外で多くのUDI規制が進み、データベースの稼働も始まっている。海外事例も参考にし、医療安全の向上のためにどのような仕組みとするべきなのか、という議論がいまこそ必要である。
【参考資料】
1) Guidelines on minimising the risk of transmission of transmissible spongiform encephalopathies in healthcare settings in Ireland, 2004
https://www.hpsc.ie/az/microbiologyantimicrobialresistance/infectioncontrolandhai/guidelines/File,1193,en.PDF〈2024年7月11日参照〉
2) Review of guidelines for prevention of Creutzfeldt–Jakob disease transmission in medical settings in EU Member States and Norway, 2011
https://www.ecdc.europa.eu/sites/default/files/media/en/publications/Publications/1106_TER_Review_of_guidelines_for_prevention_of%20CJD.pdf〈2024年7月11日参照〉
3) プリオン病感染予防ガイドライン(2008 年版), 厚生労働科学研究費補助金・難治性疾患克服研究事業, 2008
http://prion.umin.jp/guideline/pdf/cjd_2008all.pdf〈2024年7月11日参照〉
4) UDI Guidance; Unique Device Identification (UDI) of Medical Devices, 2013
https://www.imdrf.org/sites/default/files/docs/imdrf/final/technical/imdrf-tech-131209-udi-guidance-140901.pdf〈2024年7月11日参照〉
5) Unique Device Identification system (UDI system) Application Guide, IMDRF, 2019
https://www.imdrf.org/sites/default/files/docs/imdrf/final/technical/imdrf-tech-190321-udi-sag.pdf 〈2024年7月11日参照〉
*1:豊胸材が医療機器といわれると違和感を覚える方もいると思うが、医療機器の範疇には、人工呼吸器やCTなどの機械的なものから、メスや鉗子などの手術器具、豊胸材や人工関節、シリンジ、絆創膏といった材料まで含まれる。
*2:GS1は世界の100か国以上の国と地域の代表によって構成される、国際的な非営利の標準化団体である。GS1標準は、GS1が規定しているコード体系やバーコードの基準を指す。
(C)2024 Youichi Umemura & Sakata Warehouse, Inc.