第370号 医療機器におけるUDIの動向 (2017年8月22日発行)
| 執筆者 | 植村 康一 (一般財団法人 流通システム開発センター ヘルスケア業界グループ グループ長) |
|---|
執筆者略歴 ▼
目次
1.はじめに
UDI(Unique Device Identification)という言葉が医療機器業界では一般的になりつつある。UDIは医療機器の固有識別という意味であるが、医療機関で使用される医療機器や材料などを固有に識別し、医療安全の向上や最適な治療の提供をはかるための運用体系全般の意味も持ち合わせている。
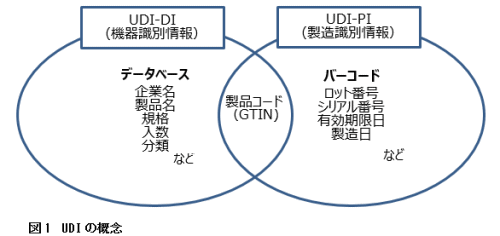
日本を含む世界各国の規制当局が参加している国際医療機器規制当局フォーラム(IMDRF)は、UDIに対する世界的に整合された一貫性のある取り組みがなされることを期待して、2013年にUDIガイダンスを発行した。UDIガイダンスでは、UDIにより特定の製品を識別することができることと、物流から機器の使用現場に至るまでの過程を通して一貫して共通のUDIが使用されることが求められている。このためには、製品への国際的に標準化された製品識別のためのコード設定とバーコード(あるいは電子タグ)の表示に加えて、正確な情報が登録されたデータベースが整備されていることが条件となる(図1)。
図1.注)固定情報である製品コード、企業名、製品名などは機器識別情報(UDI-DI:UDI-Device Identifier)としてデータベースで管理し、ロット番号、有効期限などの変動情報である製造識別情報(UDI-PI:UDI-Production Identifier)はバーコードに表示する。製品コードが両者の情報を結合するキーとなる。GS1標準では、製品コードにはGTINが用いられる。
現在、世界各国でUDIのためのバーコード表示とデータベースへの登録が進行あるいは計画されており、国際的な標準化団体であるGS1(ジーエスワン)注)の定めるコード体系とバーコードがほとんどの国で採用されている。また、正確なデータベース構築が欠かせないため、アメリカ、EUを含め多くの国ではバーコードの表示に加えてデータベース登録も義務化されている。
注)GS1:世界の110以上の国と地域の代表によって構成される、サプリチェーンの効率化、可視化などのための流通情報システムの標準化を行う非営利の標準化団体である。GS1が定めているコード体系やデータキャリアなどはGS1標準と呼ばれ、世界各国で使用されている。
2.海外各国のUDI規制動向
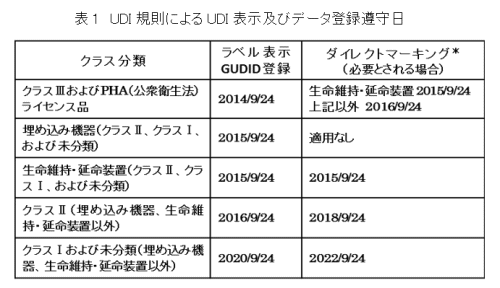
アメリカでは2013年にFDAからUDI規則が公表され、医療機器のリスクに応じたクラス分類ごとに、機器本体および包装単位へのバーコードの表示と医療機器データベース(Global UDI Database: GUDID)へのデータ登録が進められている(表1)。現在すでに高リスク製品であるクラスⅢ、クラスⅡの医療機器のバーコード表示とデータ登録は必須となっている。低リスク製品であるクラスⅠの医療機器については、当初2018年9月が登録期限とされていたが、データ品質、データ利用などについて検討し最適化をはかるとの発表が2017年6月にあり、2020年まで期限が延長された。なお、クラス分類にかかわらず、洗浄、滅菌処理等により繰り返し使用する医療機器については、機器本体への刻印などによるダイレクトマーキングが要求されている。
表1.注)*繰り返し使用のために、洗浄、滅菌処理する医療機器には、レーザー方式またはドットピーン方式などの恒久的な方法によるダイレクトマーキングでのUDI表示が必要である。
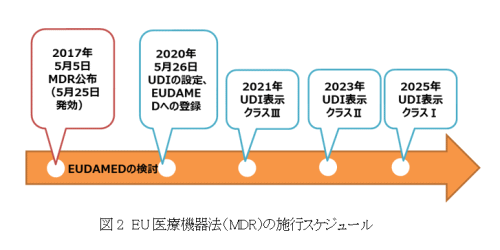
EUでは、2013年4月に欧州委員会がUDIシステムの枠組み推奨を公表していたが、2016年6月15日、EU議会が正式に枠組みを合意し、2017年5月5日、UDI規制が盛り込まれた医療機器法が公表された。バーコードの表示やデータベース登録など、アメリカFDAのUDI規則に類似しているが、細かい点では違いもあるため実施にあたっては注意が必要である。施行は3年後の2020年5月26日であり、その時点でクラス分類に関わらず、まずEUの医療機器データベース(European Databank on Medical Devices: EUDAMED)への登録が必要となる(図2)。アメリカと同様、ダイレクトマーキングについては各クラスともUDIラベル表示の2年後が期限となる。
アジア各国でもUDIに関する関心は強く、韓国、台湾などで法制化の動きがある。韓国は2016年に医療機器法が改正され、その中にUDIの項目が記載された。アメリカ、EUと同様にデータベース構築が検討されており、2017年中にはUDIの運用細則が公表される予定である。台湾でもアメリカと同様の規制が準備されているが具体的な時期についてはまだ公表されていない。
3.国内の動向
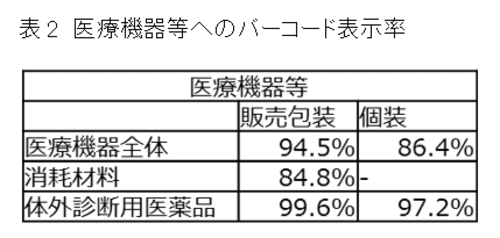
海外と比較して国内のバーコード表示は開始も早く、表示率も高い。国内の医療機器と体外診断用医薬品へのバーコード表示は、2008年3月28日の、厚生労働省医政局経済課長通知「医療機器等へのバーコード表示の実施について」に従って実施されている。その結果、2015年の調査において、すでに医療機器全体で約95%、消耗材料でも約85%の製品にはバーコードが表示されている(表2)。
表2.注)厚生労働省「医療機器等における情報化推進状況調査(2015年9月時点調査結果)」より抜粋
しかしながら、医療機器本体へのバーコード表示は対象から除かれており(表示対象は包装単位のみ)、また、あくまで通知であることから強制力が働きにくいためUDIとしては不十分であると言える。また、通知が発出された2008年当時は二次元シンボルであるGS1データマトリックスが利用されていなかったこともあり、小サイズ包装や機器本体への表示が今後の検討事項として取り残されたままになっている。そのため(一社)日本医療機器産業連合会(医機連)では、2015年3月に「医療機器等のUDI運用マニュアル」を発行し、GS1データマトリックスの使用、可搬式の医療機器や手術用鋼製器具などに対する製品本体へのバーコードの直接表示を推奨するなど一歩進んだ対応を提唱している。また同マニュアルには、各国のUDI規制の進展により、今後海外製品にもGS1標準のバーコード表示が増加することを踏まえ、海外の製造元で表示されたバーコードの積極的な利用も盛り込まれている。
このような背景の下、2016年12月、医療製品識別コードによるデータの利活用を推進し、医療の質と安全性・効率化に寄与することを主テーマとして、医機連を事務局とする「医療製品識別とトレーサビリティ推進協議会」が発足した。産業界はもとより医療従事者、医療関連団体、行政などステークホルダーが一同に会し討議が行われている。同協議会にて、トレーサビリティを確保するためのデータベース構築とその効率的な運用を行うための適切な仕組みについて議論され、さらにはUDIの法制化が進むことを期待したい。
4.製品識別のためのコード設定とバーコード表示
UDIのための製品の識別コードとバーコードには多くの国でほとんどの製品に対してGS1標準が利用されている。アメリカ、EUではHIBCC(Health Industry Business Communication Council)とICCBBA(International Council for Commonality in Blood Banking Automation)のコード体系も利用可能であるが90%近くの製品にはGS1標準が使用されており、国内ではGS1標準のみが認められている。GS1標準では、製品コードとしては、GTIN(Global Trade Item Number)が、バーコードには有効期限、シリアル番号やロット番号などを表示することができるGS1-128シンボルまたはGS1データマトリックスが利用される(図3)。
5.輸出入商品に対する注意点
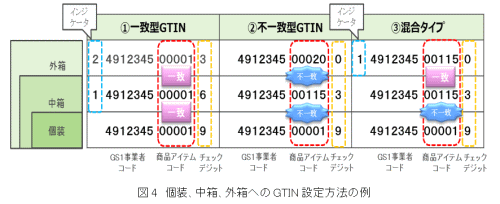
国内の事業者が製造する医療機器等に対しては、基本的に製品識別のためのコード設定はGTIN、バーコード表示には、GS1-128シンボルが利用されているが、国際標準とは若干ながら認識や運用の違いがある。例えば、GTINの設定に関しては、国内の場合は中箱、外箱などがある場合、そのほとんどが一致型と呼ばれるGTIN-14を用いる方法で設定されていること(図4)、変動情報であるUDI-PIが有効期限、ロット番号あるいはシリアル番号に限られており、その他の変動情報の利用がほとんど考慮されていないことなどがあげられる。また、バーコードに関しては、日本の業界で取り決めたGS1-128シンボルのサイズが、国際標準に比べてやや小さめであること、海外製品には日本ではほとんど利用されていないGS1-128シンボルの2段表示(図5)やGS1データマトリックスの表示が比較的多いことなどがあげられる。また、すでに規制が始まっているアメリカでの独自ルールも存在する。
卸売販売業者や医療機関でバーコードが読み取れないといったトラブルを避けるためには、輸出品に対してはその対象国の規制内容を考慮した表示とすることが必要であり、輸入品に対しては、読み手側が、国際標準を理解した上で、必要なデータをバーコードから取得するための柔軟なシステム構築をすることが必要である。
図4.注)通常個装にGTIN-13(JANコード)を設定する。①一致型では中箱、外箱にインジケータを用いたGTIN-14を設定するが、②不一致型では全ての包装単位をGTIN-13で設定する。
国内事業者ではほとんどの場合①一致型でGTINが設定されるが、海外では②不一致型や③混合タイプで設定されることも多い。なお、GTIN-13をGS1-128シンボルやGS1データマトリックスに表示する場合は、先頭に“0”を付加し、14桁として使用する。
6.おわりに
国際的に整合の取れたUDIを進めるため、GS1標準に基づくコードの設定とバーコード表示が世界各国で進められている。UDIは患者安全の向上や患者ケアの最適化を行うための基盤となるものであり、バーコードの正しい表示と適切な読み取りは欠くことのできないプロセスである。そのため流通システム開発センター(GS1Japan)では、2017年3月より「医療機器等のためのUDI対応バーコード表示ガイド」をGS1ヘルスケア協議会のホームページ(http://www.dsri.jp/gshealth/)で公開している(図6)。本ガイドでは、医療機器に特有のGTIN設定方法や具体的なバーコードサイズなどについても記載している。すでに公表しているGS1のルールに関する資料などと合わせてお読みいただきたい。
以上
(C)2017 Kouichi Uemura & Sakata Warehouse, Inc.