第152号欧米ヘルスケア業界の医療安全への取組み動向 ~欧米医療情報システム実態調査団を実施~(後編)(2008年7月15日発行)
| 執筆者 | 黒澤 康雄 (財団法人流通システム開発センター 国際流通標準部 次長) |
|---|
目次
ローヤルフリー病院 (英国)
(1)中央滅菌部門の概要
ローヤルフリー病院は、英国の国民保健サービス(NHS: National Health Service)の病院として、約900床、職員医療従事者を含め約4,900人の 規模の病院である。1990年英国厚生省発効の「NHSコミニュテイ・ケア法」の適合を受けて「ローヤル・フリー・ハムステッドNHSトラスト」と呼ばれる。医師、看護師、技師、薬剤師等の研修サービス及び臨床検査センターがある。中央滅菌室は24時間態勢で稼働し、スタッフは28名が交代制で運営している。滅菌室のレイアウトは【不潔回収エリア】【準清潔エリア】【清潔エリア】の3ゾーンで構成。手術で回収された器材類は次のような流れで滅菌される。
【不潔回収エリア】→ディスインフェクター→【準清潔エリア】→オートクレーブ→【清潔エリア】
①不潔回収エリア
手術室から、使用済み器材類がカートで回収されてくる。使用済み器材類の回収に際し手術室内エリアでは、一切予備的な一時洗浄等の処理は施しておらずそのまま回収している。回収に際しては、セット毎に2次元データマトリックスのラベルを読取り履歴管理を行っている。
②準清潔エリア
ディスインフェクターの工程を経て、準清潔エリアに器材が搬入されセット組みが行われる。新規に2次元データマトリックスラベルが印字され、器材セットに貼付される。一部の滅菌器材(鉗子等の鋼製小物が中心)に、約2×2mm程の大きさのデータマトリックスがレーザーマーキングで刻印されていた。このデータマトリックスを、院内では「タトゥー=刺青」と呼んでいる。データマトリックスは、特に脳外科や眼科、視神経系の手術器材に刻印されている。クロイツフェルト・ヤコブ病患者の手術使用記録に活用するとのことである。ただし、過去に実際に運用した事例は、担当者の在任期間では無いとのことである。5年前に制定された、英国のヤコブ病患者への滅菌器材の運用規定では、手術済み器材は以前全て破棄されていたが、コスト削減事由もあり「再生器材は、同一患者にのみ、該当する器材のリユースが認められる。「タトゥー」を読み取ることで、患者別個別管理が行なわれる。器材へのデータマトリックスのレーザーマーキングは外注化され、その費用は病院が負担し、一部国からの補助を受けている。英国内には複数のマーキング外注業者が業務を行なっている。データマトリックスの活用目的は「安全管理」である。事故等が起きて患者から病院が訴訟を受けた場合このデータを基本に対応を行うが、これまで実際の提供事例は無いとのことである。
③清潔エリア
ガス滅菌器設置はなく滅菌器はオートクレーブのみであった。




| Q1: | 2次元シンボルを活用した手術器具の管理運用は英国の病院では一般的なのか? |
| A1: |
ローヤルフリー病院が先端を行っており、他の病院での事例は知らない。 (関連情報) 現場説明者は「他の事例は知らない」との回答であったが、GS1HUGセミナーの発表資料によると下記のようにマンチェスター中央小児病院、マンチェスター大学附属病院、チャリングクロス病院等、先進的な病院では感染症対策としての履歴管理が進められている。 |
| Q2: | 清潔エリアにガス滅菌器がないのは何故か? |
| A2: | 本院はオートクレーブ滅菌対応が可能な器材しか扱わないため、ガス滅菌器は無い。 |
(2)薬剤部門の概要
①入院患者向け薬剤部門
入院患者向け薬剤部門では、主にピッキングロボット(XY座標ロボット)による医薬品の収納と払出装置を中心に説明を受ける。薬局内に約幅5m高さ3m奥行き10m程度のスペースが設けられ、正面はガラスで仕切られおり、床から天井間の左 右に複数の保管棚が仕切られ、中央部を、薬剤自動収納と払出しのピッキングロボットが稼動している。
この装置を使用することで、入院患者への薬剤の棚への収納及び処方による払出しで「間違い無く安全」と、「効率良い運用」が実現されている。装置は、「操作コントロール部分」「薬剤投入口」「ロボット稼動部」から構成。


②-1納品された薬剤を払出し装置に収納する。
操作コントロール端末を操作して、薬剤投入口に薬剤を置く。
| a) | 薬剤の箱に印刷されたバーコード(JANコードに相当)を入り口に設置されたスキャナで読み取り、操作画面で「品名」を確認する。 |
| b) |
箱に印字の有効期限の数字を見ながら、「有効期限」を手入力する。有効期限の使用安全性を加味して、実際の有効期限よりも1ヶ月間短く入力することが運用規則である。 例)「2010年9月30日」迄の有効期限の場合→「2010年8月30日」と入力 |
| c) | ベルトコンベアーで薬剤が装置内部の棚に運ばれる。 |
| d) | ロボットアームが薬剤の箱をつかみ、棚の空きスペースに移送して収納する。 |
| a) | 装置横のオペレーションデスク端末で、処方オーダを入力する。 |
| b) | ロボットアームが該当する薬剤を棚から取り出し、螺旋状のシューター(写真)上部に薬剤を落下させるために置く。オペレーションデスクの払出し口のトレイに該当薬剤が滑り落ち、払出される。同時にオーダ情報が印字された処方ラベルが端末横のラベルプリンタより印字される。担当者は払い出された薬剤の監査を実施し、間違いがなければ処方ラベルを薬剤パッケージに貼り付ける。トレイにいれられた薬剤は入院患者に運ばれる。 |

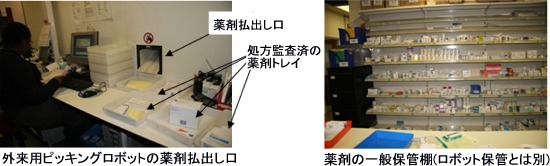
③外来患者向け薬剤部門
入院患者向けのピッキングロボットと同様の装置を別途使用して外来患者の薬剤払出しを行っていた。
| Q1: | 薬の収納および払出しのロボット装置はどこのメーカーか? |
| A1: | ドイツ製だがメーカー名は不明。同様な装置メーカーは6社ほどある。 |
| Q2: | この装置の収納棚にはどのくらいの薬剤が納められているか? |
| A2: | 約1,000アイテムである。 |
| Q3: | この装置に収納しない薬剤も多数あるがどのような区分けをしているのか? |
| A3: | 区分けとしてサイズが大きく、自動払出し装置に納められない薬剤は一般棚に在庫する。また払出しの単位が梱包(箱)単位と一致せず、残在庫(バラ収納)が発生する薬剤は、一般棚に在庫する。 |
| Q4: | 薬剤部に訪れる外来患者の数は一日何人か? |
| A4: | 200人から250人 |
| Q5: | 外来診察時間は? |
| A5: | 9時15分~18時30分。今後21:00迄の診察時間の延長を予定している。 |
⑤まとめ・所感
英国のNHSによる病院運営は、税金でまかなわれているので、患者の自己負担は無く、院内に費用徴収のための会計部門が無いということで有名である。手術用鋼製器具に2次元シンボルのデータマトリックスがマーキングされていたことは、英国病院の一部とはいえ、大阪大学医学部付属病院での運用と同様、2次元シンボルの表示や運用に関して、英国の病院は数段階進んでいるとの印象を持った。薬剤部のピッキングロボットの稼動、運用は日本では見かけないものである。相当な設置スペースを必要としていることから、人手による運用と比較してどの程度効率が良いのかどうか、今後日本でも同様の導入展開があるのかどうか等、今後の業界動向に注目をしたい。
米国食品医薬品局(FDAアメリカ)
(1)医療機器(本体)の製品識別の法制化
医療安全の視点で医療機器(本体)の製品識別(ユニーク・デバイス・アイディンティフィケーション: UDI)の推奨規則の方針案がCDRHによって作成された。UDIを含む新法案が半年から1年以内に制定の見込みである。CDRHはCenter for Devices and Radiological Health、放射線・医療機器センターの略称である。担当マネージャーから「医療機器ユニーク識別による情報化の取組み」について最新の詳細情報を把握した。CDRHが規制対象としている製品は、医療機器(ペースメーカー)、治療装置(レーザー)等であり、リスク分類別ではクラスⅠ(低リスク):782品目、クラスⅡ(中リスク):799品目、クラスⅢ(高リスク):119品目である。

(2)CDRHの組織について
米国医療機器産業に関する2004年のデータでは、製造業者数は約15,000に上り、従業員数10人以下の小企業が約三分の二を占めている。全体の売上規模は3,200億ドル(約38兆4000億円)で、従業員数500人以上の大企業が売上規模の約9割近くを占める。医療機器製造業者数は年々増加しており、医療器具(Instruments)と外科分野(Surgical)がそれぞれ三分の一を占めており割合が高い。これに伴ってFDA へのUser Fee(登録費)は年約8%増加している。
連邦規則コード・タイトル21(21CFR)に関して、医療機器へ適用される一般的永久規則はParts800-1299となっている。米国へ医療機器を上市する最も一般的な方法は、510(k)申請とPre-market Approval(PMA)である。510(k)(21 CFR Part 807)は、少なくとも市販90日前に申請し、既に上市済みの機器と安全性と有効性に関する同等性を実証することである。約46%が510(k)プロセスによって上市されている。
PMA(21 CFR Part 814)はクラスⅢの機器のみが対象で、クリニカル・データClinical Dataに基づいて安全性と有効性を証明する。毎年7%の機器がPMA承認によって上市されている。
市販後の医療機器製造業を監視する手段として、GMPs(Good Manufacturing Practices)として良く知られるQuality Systems(QS)(21 CFR Part820)は、医療機器の設計、包装、表示、及び製造に関する品質保証についての規則である。Medical Device Reporting(MDR) (21 CFR Part 803)は有害事象(死亡や重大な機能不全)の報告に関する規則である。
FDA/CDRHでは医療機器市販後の調査として、インプラントに関する不具合事象の研究やインプラント、及び生命維持装置の所在を追跡するトレーサビリティを重要視している。
(3)ユニークデバイス識別(UDI)について
FDAは医療過誤対策として、2004年に医薬品と生物由来製品に対するバーコード表示を義務化したが、この時点では医療機器への表示は義務化されなかった。FDAは2005年に学会や病院団体から医療機器へのバーコード表示に関する書簡を受けて検討を開始した。
医療機器を取り巻く状況としては、28,000社以上に上る会社と10万点以上の型式が存在し、様々なサイズと数量、再使用/単回使用など多種多様で複雑な条件がある。
FDAはUDIが互換性や相互の操作性に関する医療過誤の諸問題(正しい患者へ正しい装置の使用、正しい装置とアクセサリーの組合せ、MRIコンパチビリティ)を解決し、リコールや偽造薬防止に有効と考えている。
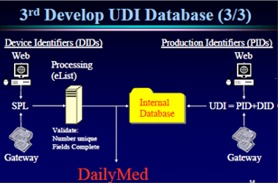
UDIシステムに関する3つの明確な概念は、①標準システムの開発、②ヒト及び機械の両方で読み取れる表示手段、③最小限のデータ含むデータベースの創出である。
1番目のUDIシステムの開発は、標準コードとしてGS1またはHIBCCを選択し、UDI=Unique Device ID(製造業者あるいは型番:例 GTIN)+Production ID(シリアルNo. あるいは ロットNo. あるいは 消費期限)である。
2番目の機器上のUDI表示は、装置直接表示か、ラベル表示か、または両方表示かである。使用単位ごとにヒトが読めること(ヒューマンリーダブル)、機械による自動データ識別はバーコード、2次元シンボル、RF-ID、ダイレクトパーツマーキング(DPM)などのいずれかから選択する。
3番目のUDIデータベース開発は、1.機器の個体識別(製造業者、型式、サイズ等の製品属性)、安全使用のための情報などが、データベースに入れるべき仕様項目である。データベースは”Daily Med”によって公開されるオープンシステムであるが、詳細はCDRHにおいてまだ研究中である。
UDIを含む新法案が半年から1年以内に制定の見込みである。UDIの適用は新製品のみとし、既存製品は法案の対象外である。
FDAではUDIデータベースに関する研究を現在行っているため、日本の(財)医療情報システム開発センター(MEDIS-DC)のデータベースに関心を示していた。大阪大学での研究事例に関しては、ダイレクトマーキングの必要性や重要性に関して強い賛同の意思を示していた。
| Q: | UDIの対象となるMedical Deviceの範疇は?手術用手袋やソフトウェアも含まれるのか? |
| A: | 含まれる。手術用手袋のUDIは箱単位、大型の診断装置ではいくつかのパーツごとに分かれる場合もある。 |
| Q: | シングルユースの再滅菌品に関するUDIはどうなるか? |
| A: | 米国ではシングルユースの再滅菌販売業者がある。再滅菌は再製造であるから、再UDIが必要になる。病院内でシングルユースを再滅菌するケースが実際に存在していることは知っているが、これは法的には認められていない。 |
| Q: | UDIは医療機器業界にとっては多大な投資が必要となる。UDIの対象外となる機器はあるか? |
| A: | 医療機器業界が導入費用の面で不満をもっていることは承知している。しかし、FDAの法制化は強制力があるので、例え不満があっても遵守しなければならない。Exception(除外、例外)は考えられるが、現時点では決まっていない。また、UDI導入までの猶予期間の設定は考えている。クラス分類では、順次リスクの高い機器から適用になる可能性が高い。(クラスⅢ⇒クラスⅡ⇒クラスⅠの順) |
(5)まとめ
GS1のHUG(ヘルスケア・ユーザー・グループ)国際会議で発表されていたFDAのUDIへの今までの取り組みは、極めて概念的な内容であったが、今回の訪問では一歩踏み込んだ具体的な内容を紹介いただいた。米国医療費の増大に対して医療費削減が政策的に必要とされているが、一方で米国は医療ITの設備投資に対して保険費用を払う保険会社もある。UDI投資が医療安全に貢献すると保険会社が判断すれば、米国ではUDIが少なくとも医療機器メーカーには確実に普及すると予想される。課題は、ユーザー(医療機関)の利用にある。FDAは医療機器メーカーに対しては強制力を有しているが、ユーザーに対しては手段がない。
なお、日本の医療機器メーカーにとって、現在FDAが検討中のUDI標準システムに対応できない困難性は現時点ではないと思われる。また、デバイスへのダイレクトマーキングに関しては、現時点では未だ技術的な課題があることをFDAも認識している。逆に現在は、オプション、例外と位置付けているダイレクトマーキングが技術的にブレイクスルーすれば、米国では一気に広まるものと考えられる。
以上
(C)2008 Yasuo Kurosawa & Sakata Warehouse, Inc.

















