第107号医療材料・医薬品の識別管理のためのバーコード利用――患者・利用者の安全確保のために識別技術が必要――(2006年9月7日発行)
| 執筆者 | 黒澤 康雄 (財)流通システム開発センター 流通標準本部国際流通標準部次長 |
|---|
目次
- 1.患者や利用者の「安全性」確保のために
- 2.医療分野へのIT利活用の明示
- 3.薬事法の改正
- 4.メーカーは30年間、病院は20年間記録義務化
- 5.何をシステム化すべきなのか
- 6.材料メーカーでは物流アウトソーシング
- 7.医薬品業界の標準化
- 8.欧米医療業界の状況
- 9.米国における業界の取り組み
- 10.国内業界の課題
1.患者や利用者の「安全性」確保のために
トレーサビリティ(履歴・追跡管理)が社会基盤システムとして構築されなければならない第一の分野は、ヒトの生命と健康に直結する医療業界である。特に医療業界は国内外ともに、患者や利用者の「安全」が医療事故によって損なわれている状況にあり、人間工学も含めた情報識別技術が医療現場に常態的に導入されるべき分野である。
2.医療分野へのIT利活用の明示
2003年7月、政府IT戦略本部から「e-Japan戦略Ⅱ」において、医療分野はIT利活用の先導的取り組みを行う分野として第一に位置付けられ、「患者基点の総合的医療サービスの提供」、「医療機関の経営効率と医療サービスの向上」、「診療報酬請求業務の効率化」等が、それぞれ目標到達の年度を分けて明示されており、現在、医療業界のIT化は、国の政策の重要テーマとなっている。
また、2003年12月、厚生労働大臣より「医療事故対策緊急アピール」が発出され、もの(医薬品・医療機器・情報等)を軸とした施策として、治療法選択に係るEBM(Evidence Based Medicine最良の根拠に基づく医療実践)の確立およびガイドラインの作成支援、薬剤等の使用に際する安全管理の徹底(二次元バーコード、ICタグの利用)、ITの導入・活用(医療安全のためのオーダリングシステム活用)、輸血の管理強化、新しい技術を用いた医療安全の推進等々が指示され、医療安全は国民の大きな関心事である。しかし、内閣府の調査によると、その普及推進は必ずしも進展していないと指摘がなされている。
3.薬事法の改正
医療業界では、2003年7月施行された改正薬事法の中で、「生物由来製品」に対する安全性確保が義務化され、(1)医療関係者による生物由来製品の安全性確保 (2)医療機関による医薬品の副作用、医療材料の不具合、感染症例の厚労省への報告 (3)医療機関主体による治験実施等への対応が求められている状況にあり、情報技術を活用したトレーサビリティ(履歴・追跡管理)の構築が課題となっている。生物由来製品とは、血液製剤などヒトや動物を原料とする医薬品のことであり、いわゆるBSE(狂牛病)や未知のウイルス等にヒトが感染するリスクがあるとされ、患者救済及び感染被害の拡大防止のために薬事法が改正されている(図1)。
図1 「生物由来製品」製造・販売・使用について
記録保管、トレーサビリティの義務化

医薬品・医療材料の品質、安全性の確保のためには、従来からGMP(Good Manufacturing Practices医薬品の製造品質管理規則)やGPMSP(医薬品市販後調査基準)等によって、製造工程から市販後まで、さまざまな安全対策が実施されてきたが、改正薬事法では生物由来製品という新規枠を設け、その中でも特別な配慮が必要な製品である特定生物由来製品については、安全対策が追加(上乗せ)規定されている。
4.メーカーは30年間、病院は20年間記録義務化
医薬品・医療材料メーカーでは、製造工程における生物由来製品の原材料の安全性確保、市販後の製品添付文書への適切な表示、ドナー記録・販売記録の30年間の保管、感染症の定期報告が、また医療機関・薬局では、特定生物由来製品の使用記録作成及び20年間の保管が義務付けられている。このように医療サプライチェーン全体にわたる、業態を超えた各拠点における製造、販売、使用記録の作成、保管、報告等についてトレーサビリティの視点でのシステム的な対策が緊急課題となっている。
5.何をシステム化すべきなのか
医療事故対策として、医療現場のどのような場面でどのような業務をシステム化すべきなのか。そのシステム化すべき業務は、「与薬業務」である。
厚生労働省の厚生科学研究である「医療のリスクマネジメントシステム構築に関する研究」によると、収集事故総数11,148件について、事故となった看護業務を患者の療養上の世話と医師の診療の補助業務(予薬・処置等)の2つに大別した場合、患者の療養上の事故では患者側要因の関与も大きいが、医師の診療の補助業務の事故の大半は医療提供者側の要因によって発生していた。療養上の世話事故が全体の約3割で、その半分が転倒転落事例であった。一方、医師の診療の補助業務の事故は全体の6割であった。うち内服と注射(点滴含)の与薬関連事故が合わせてその4分の3を占めていた。特に注射事故は約3,500件と全体の3割を占めており、その多くは与薬業務に関する事例であったと報告されている。したがって、医療事故対策の中心は、与薬業務におくべきと考えられている。
6.材料メーカーでは物流アウトソーシング
現在、我が国の医療資材における商品識別のために標準化されたコード体系、バーコード表示は、日本医療機器産業連合会が医療材料を対象に「商品コード体系はJANコード、バーコード表示はソースマーキングによるUCC/EAN-128とする」旨を業界決定しており、現在は普及活用の段階にある。特に先進の医療材料メーカーは、受発注、在庫、入出荷等の業務を物流会社に外部委託し、物流コストを削減しつつ、本業である製品の研究開発、販売に特化しており、このようなアウトソーシングは増加傾向にある。また、医療材料の卸売業界でも、物流会社と提携し、共同集荷・在庫・納品体制を進めている卸販売会社が出現している。
7.医薬品業界の標準化
一方医薬品については個装(最小投薬・最小使用単位)への商品コード、有効期限、ロット番号を内容とするバーコード表示は、厚生省の検討会で、使用するバーシンボルにRSS合成シンボルとUCC/EAN-128が、データ表示項目に商品コード、有効期限、製造番号、数量が選ばれ、2006年夏に業界へ通知が予定されている。これによって、医薬品へのシンボル表示が普及することによって院内や調剤薬局でのコンピュータによる製品識別をもとに、使用・調剤の照合確認を始めとして受発注、在庫棚卸、使用実績等のシステム管理に利活用ができることとなる。
8.欧米医療業界の状況
米国・ヨーロッパの医療業界でも投薬調剤ミス、手術ミス、誤診等が多発しており、患者に対する損害賠償の支払額が増加し、医療機関の負担増が大きな社会問題となっている。このような事故防止のために国際EAN協会(現GS1)は、行政機関、業界団体、各国のGS1組織と協力して、ヘルスケアプロジェクトを設立し、標準商品コード体系、標準化バーコード(UCC/EAN-128、RSS合成シンボル等)、標準EDIメッセージ等、EAN・UCC標準仕様(図2)の普及推進を行っている。
図2 EAN・UCC 標準とは

9.米国における業界の取り組み
2002年7月、米国食品医薬品局(FDA)が医薬・医療製品へのバーコード・ラベリング公聴会を開催し、RSS、合成シンボルの有効性が確認され、FDAは米国コードセンター(現GS1US)の支援を得て、GTIN体系(図3)及び標準バーコードを含むEAN・UCC標準を基本とする表示規制の制定作業を開始した。04年2月、FDAは全ての医薬品・血液製剤にGTIN体系及び標準バーコードを表示する推奨規格(Bar Code Label Requirement For Human Drug Products and Biological Products)を作成し(図4)、04年4月から、新薬については承認後60日以内に表示する、また既承認品については表示猶予期間を3年とする等、義務化を進めることとなった。
図3 GTIN データ体系とは
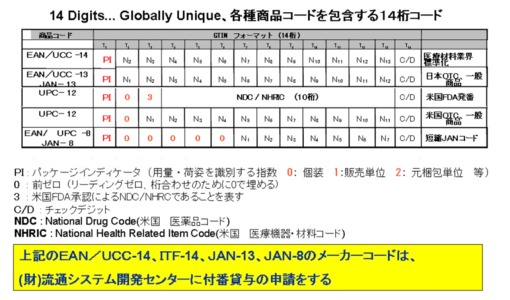
図4 FDA 医療用医薬品・血液製剤
バーコード表示義務化(www.fda.gov/掲載)

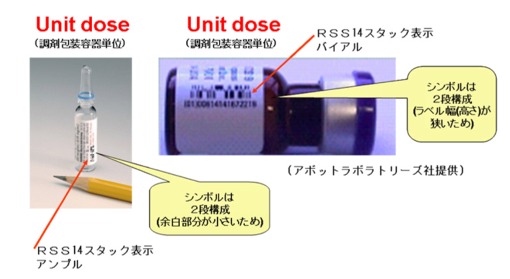
米国の規制化の目的は、①患者の安全対策 ②近年増加中の医薬品の偽造防止 ③副作用・不具合事故の発生拡大の防止・製品の早期回収である。FDAの規格化、義務化に先行して、ファイザー社、アボット・ラボラトリーズ社等の大手医薬品メーカーでは、既に最小投薬単位(Unit Dose:錠剤1錠、アンプル1本、バイアル1本単位)にRSS合成シンボル(図5)をソースマーキングして市場へ製品供給を行っている(写真1・写真2・写真3)。
図5 RSS合成シンボル概要
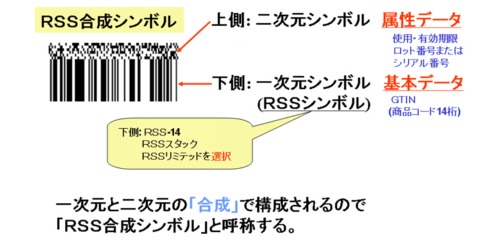
写真1 ファイザー社固形製剤表示例
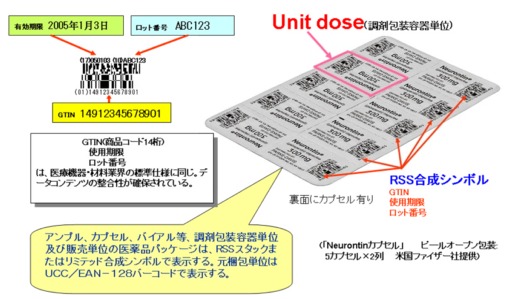
写真2 アボット社 アンプル表示例
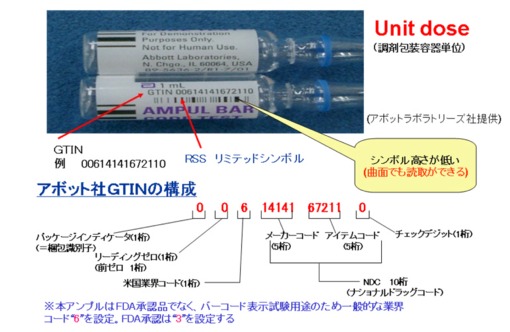
写真3 アボット社ガラス小瓶表示例
10.国内業界の課題
米国医薬品メーカーは、FDAの義務化に先行する形で既に最小投薬単位へのRSS合成シンボルの表示を対応済みであり、国内製薬メーカーでも同様の対応が進むものと予想される。国内で多発する医療事故を防止し、患者の安全を確保するためには、最小の投薬単位である医療資材全般について、識別表示を早急に行い情報技術を利用して、医療現場における投薬照合、使用実績・追跡管理等の業務システムの実現が緊急課題となっている。国内の課題を整理すると下記のとおりである。
①患者の安全確保を中心とした医療情報システムの構築が必要
→ 投与投薬照合、トレーサビリティ体制の確立
②医薬品のGTIN標準化
→ JANコード表示からGTIN表示への対応(医療材料業界は対応済み)
③最小投薬・最小使用単位へのRSS合成シンボルの表示対応
→ RSS合成シンボルによるGTIN、有効期限、ロット番号の表示対応
以上
(C)2006 Yasuo Kurosawa & Sakata Warehouse, Inc.

















